

Dono de transportadora de Ribeirão Preto é suspeito de furtar diesel da Petrobras Dono de uma transportadora em Ribeirão Preto (SP), Wagner de Souza Leite é apontado pela Polícia Civil como o responsável pela operacionalização logística da quadrilha suspeita de furtar combustíveis de duto da Transpetro. Ele foi preso na man...

Jovem usa o celular em Sidney, na Austrália; país aprovou lei que proíbe acesso de menores de 16 anos às redes sociais Hollie Adams/Reuters Dezenas de adolescentes no Reino Unido participarão de testes para avaliar como eles seriam impactados por futuras restrições ao uso de redes sociais. A iniciativa foi anunciada pelo g...

O filme “Obrigado por fumar” (“Thank you for smoking”), lançado em 2005 e dirigido por Jason Reitman, é uma sátira cirúrgica sobre a indústria do tabaco e a manipulação de informações. Há uma cena antológica na qual três lobistas, dos setores de álcool, cigarros e armas, se autointitulam o “esquadrão da morte” – é incrível ...

Paisagem verde vibrante em Green Island, uma região localizada nas Ilhas Berthelot da Península Antártica. Green Island. Credit Matt Amesbury A chuva é rara na Antártica. Cientistas que trabalham em campo na região se vestem para o frio e o brilho intenso, não para o tempo chuvoso – jaquetas acolchoadas, calças para neve, ó...

Exército de Israel diz que está atacando Teerã e Beirute simultaneamente; ACOMPANHE Segundo jornalistas da Al Jazeera, houve um ataque israelense contra os subúrbios do sul da capital libanesa Forças armadas dos EUA e de Israel promoveram um ataque coordenado ao Irã neste sábado (28), após semanas de escalada de tensão entr...

O presidente dos EUA, Donald Trump, participa de uma cerimônia de entrega da Medalha de Honra na Casa Branca, em Washington REUTERS/Jonathan Ernst O presidente dos Estados Unidos, Donald Trump, admitiu nesta terça-feira que o país "não está onde gostaria" em relação à quantidade de armamento de ponta que possui. Contudo, se...

'Mísseis passam em cima da casa da minha família', diz médico palestino de Valinhos A escalada do conflito envolvendo Estados Unidos, Israel e Irã não afeta apenas turistas brasileiros que estão no Oriente Médio. Para o médico Abdel Latif, que mora em Valinhos e integra a Sociedade Islâmica de Campinas, a guerra atinge dire...
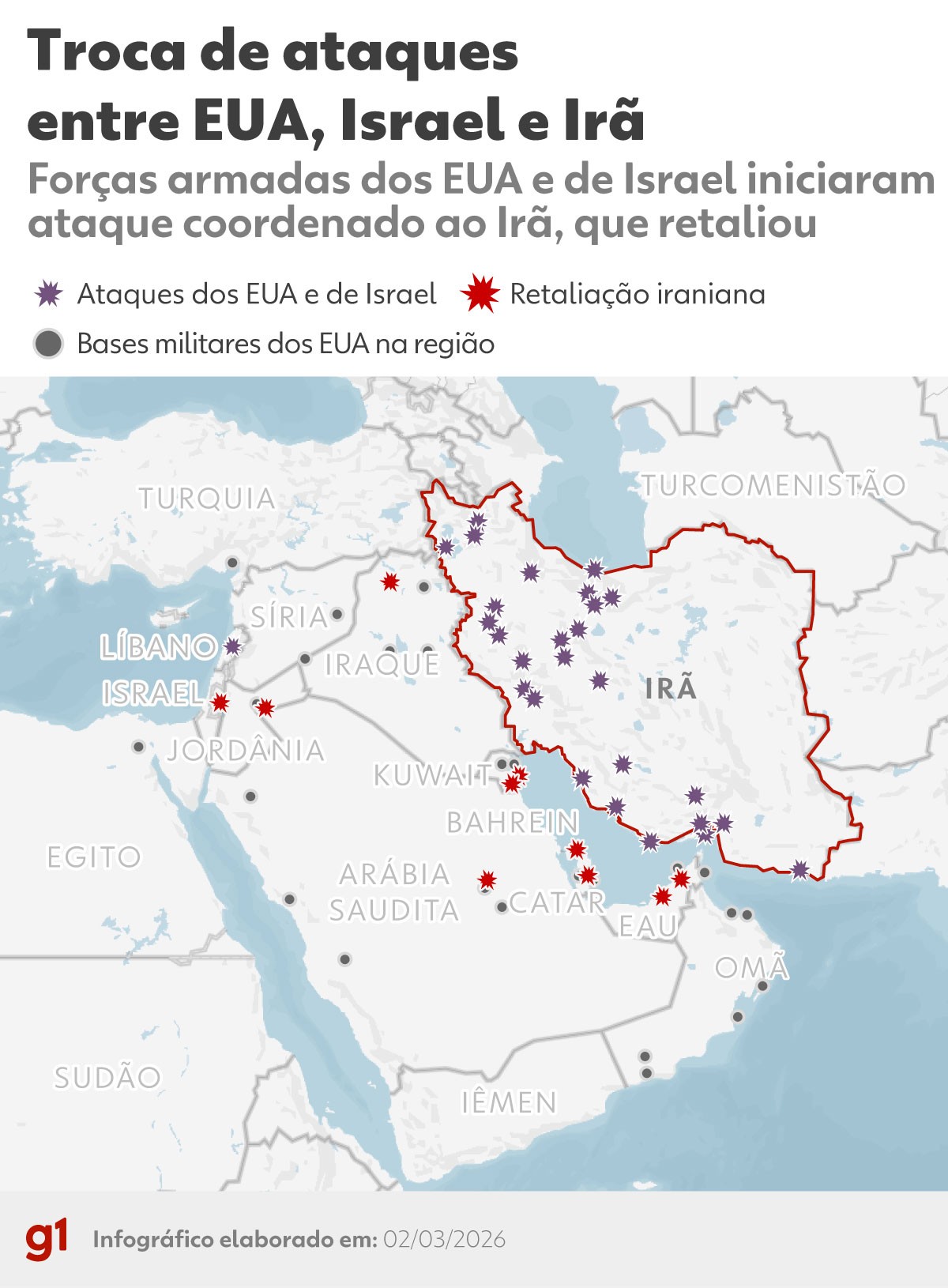
Vamos levar o tempo que for necessário, diz Trump sobre ofensiva contra o Irã O presidente dos Estados Unidos, Donald Trump, voltou a criticar o acordo nuclear firmado em 2015 entre o governo de Barack Obama e o Irã. O pacto previa limitar o programa nuclear iraniano em troca da retirada de sanções internacionais. 📱Baixe o ...

'Qualifica DF' tem 10 mil vagas em cursos gratuitos de profissionalização A Secretaria de Desenvolvimento Econômico, Trabalho e Renda (Sedet-DF) prorrogou até sexta-feira (6) o prazo de inscrições do chamamento público destinado ao preenchimento de 10 mil vagas no programa Qualifica DF. ✅ Clique aqui para seguir o canal do...

Moto Razr Fold foi anunciado durante o Mobile World Congress, em Barcelona, nesta segunda (02) Divulgação A Motorola anunciou seu primeiro celular dobrável com tela grande, o Moto Razr Fold, durante o Mobile World Congress, em Barcelona, na última segunda-feira (02). O modelo, com especificações de topo de linha, é concorre...

Briga por preço de bebida motivou assassinato de gari em Gravataí, no RS O suspeito de assassinar um gari em Gravataí, na Região Metropolitana de Porto Alegre, está foragido. O crime aconteceu em janeiro deste ano e foi gravado por câmeras de segurança. (veja acima) As imagens mostram que o suspeito seguiu o caminhão da col...

Luto no samba: morre Adriana Araújo A sambista Adriana Araújo morreu aos 49 anos, em Belo Horizonte, depois de sofrer um aneurisma cerebral. A informação foi anunciada pelas redes sociais da cantora às 15h32 desta segunda-feira (2). A artista estava internada no Hospital Odilon Behrens, na capital mineira, desde o último sá...

gustavo lima

zé neto e cristiano

henrique e juliano

jorge e matheus

luan santana